1.Réactions dues à la présence du groupement carboxyle:
A = > Formation de sels: la formation de sels se fait généralement avec la soude (NaOH) ou la potasse
(KOH).
B => Estérification: l’estérification se fait grâce à un alcool. On utilise souvent l’alcool nbutylique (Butan-1-ol) et on obtient des ester n-butyliques. Cette propriété est utilisée lors de
l’analyse par chromatographie en phase gazeuse car ces esters sont volatils. Selon l’ester
obtenu, on pourra connaître l’acide aminé présent dans le mélange.
C => Formation d’un alcool aminé : elle se fait par réduction de la fonction carboxylique en
utilisant le borohydrure de sodium NaBH4 ou le borohydrure de lithium LiBH4, elle aboutit à
la formation d’un alcool α-aminé.
D=> Formation d’amide : cette formation est à la base de la liaison peptidique.
E => Décarboxylation: La fonction carboxylique (du carbone α) peut faire l’objet d’une réaction de décarboxylation conduisant à la formation d’amine, que l’on qualifie de biogène lorsqu’elle a un rôle biologique.
Certaines de ces amines sont douées d’activité physiologique ou pharmacodynamique :
2.Réaction du NH2 :
A=> Addition de carbonyle :
Les fonctions α aminés des aminoacides réagissent réversiblement avec les aldéhydes pour
donner des bases de Schiff qui sont relativement labiles.
- Ces bases de Schiff apparaissent très souvent comme intermédiaires dans des réactions
enzymatiques impliquant les aminoacides comme substrats.
NB : La proline qui contient une fonction amine secondaire ne réagit pas avec les aldéhydes.
B => Arylation:
Cette réaction à l'aide d'un dérivé aromatique activé a permis à Frederik SANGER d'établir la
première structure primaire d'une protéine : l'insuline, hormone pancréatique qui contrôle la
production et l'utilisation du glucose.
C => Acylation :
Le réactif de Sanger a été supplanté par un réactif donnant un produit plus stable et fluorescent
permettant une plus grande sensibilité dans la détection : c'est le chlorure de dansyle (1-
diméthyl-amino-naphtalène-5-sulfonyle).
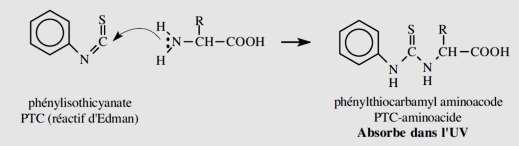
D => Carbamylation :
La carbamylation avec le phénylisothiocyanate (PTC), à un pH basique de 9, donne des dérivés
qui absorbent dans l'ultraviolet et facilement séparable par chromatographie.
De plus la réaction avec l'acide aminé terminal d'une protéine libère le dérivé d'addition et une
protéine amputée de son aminoacide N-terminal :
en itérant le processus, la détermination de la
structure primaire de la protéine sera possible (dégradation récurrente d'Edman).
E=> Désamination :
Pour maintenir la réserve intracellulaire des 20 aminoacides servant à la synthèse protéique, le
métabolisme passera par des désaminations avec oxydation qui produiront des acides α
cétoniques, source principale, sinon la seule, à partir de laquelle les aminoacides sont
synthétisés.
3.Réaction du COOH et NH2 :
La réaction avec la ninhydrine :
C’est l'une des plus connue et utilisée, elle aboutit à un produit violet pour les amines primaires
et à un autre dérivé de couleur jaune pour les amines secondaires.
L'acide aminé est complètement dégradé par une réaction de désamination et de
décarboxylation.
C’est une réaction qui se déroule en deux étapes :
- La ninhydrine (hydrate de dicéto-hydrindène) est un oxydant puissant qui par désamination
oxydative conduit à l’aldéhyde correspondant avec libération d’ammoniac et de gaz carbonique
et formation de ninhydrine réduite.
- L’ammoniac réagit avec l’hydrindantine et une autre molécule de ninhydrine pour donner un
composé bleu violacé « pourpre de Ruhemann ».
Caractéristiques :
- Réaction colorimétrique sensible.
- Lecture à 570nm.
Remarque importante :
S'il vous plaît, monsieur, ne profitez pas et partez sans partager le sujet sur les pages sociales afin de nous encourager.
Notre objectif est de vous informer
N'oubliez pas de commenter ou de donner votre opinion ou question sur le blog ou le sujet
Merci





















No comments:
Post a Comment